Инструменты пользователя
Боковая панель
Это старая версия документа!
Содержание
Глава 2. Сахарный диабет и обмен веществ
Некоторые определения и термины
ГЛЮКОНЕОГЕНЕЗ (gluconeogenesis) - биохимическая реакция, в процессе которой происходит синтез глюкозы - важного источника энергии - из неуглеводных источников (например, из аминокислот). Глюконеогенез протекает преимущественно в печени и почках, удовлетворяя потребность организма в глюкозе, когда количество углеводов, потребляемых с пищей, является недостаточным для образования требуемого количества глюкозы.
ГЛИКОГЕНЕЗ (glycogenesis) биохимическая реакция, протекающая главным образом в печени и мышцах, во время которой глюкоза превращается в гликоген. ГЛИКОГЕНОЛИЗ (glycogenolysis) - биохимическая реакция, протекающая главным образом в печени и мышцах, во время которой гликоген расщепляется до глюкозы.
ГЛИКОЛИЗ (от греч. glykys - сладкий и …лиз) - процесс расщепления углеводов (преимущественно глюкозы) в отсутствие кислорода под действием ферментов. Конечный продукт гликолиза в животных тканях - молочная кислота. Для растений характерна видоизмененная форма гликолиза, конечный продукт которого - пировиноградная кислота. Освобождающаяся при гликолизе энергия используется для жизнедеятельности животных организмов.
КЕТОГЕНЕЗ (ketogenesis) - образование кетоновых тел. Они являются нормальным продуктом метаболизма липидов и могут использоваться для пополнения запасов энергии в организме. В случае образования избыточного количества кетоновых тел у человека может развиться кетоз.
КЕТОЗ (ketosis) - повышенное содержание кетоновых тел в тканях организма. Кетоновые тела обычно образуются в результате метаболизма жиров и могут окисляться с выделением энергии. Повышение их содержания в тканях организма происходит в результате нарушения метаболизма жиров, например, при сахарном диабете или длительном голодании.
АЦИДОЗ (acidosis) - состояние, характеризующееся повышенным содержанием кислот в жидкостях и тканях организма. Развивается вследствие нарушения функционирования механизмов, отвечающих за поддержание кислотнощелочного равновесия крови
ЛИПОЛИЗ (lipotysis) - процесс расщепления липидов (особенно содержащихся в жире триглицсридов) на составляющие их жирные кислоты под действием присутствующего в организме фермента липазы.
Углеводный обмен и сахарный диабет
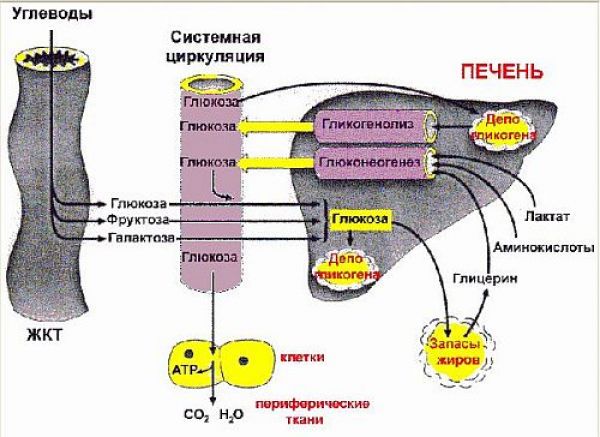
Для понимания физиологической сущности углеводного обмена применительно к сахарному диабету необходимо представление о перемещении глюкозы между органами и тканями в процессе ее запасания (депонирования) в качестве энергетического субстрата и ее расходования из накопленных тканей-депо по мере необходимости.
Главные потребители глюкозы — это нейроны головного мозга, мышечные клетки и эритроциты. Глюкоза служит основным источником энергии для этих клеток, поэтому они нуждаются в постоянном ее притоке и сильнее всего страдают от ее недостатка. За сутки у человека весом 70 кг головной мозг потребляет примерно 100 г глюкозы, мышцы — 35 г и эритроциты — 30 г глюкозы. Остальные ткани в условиях голодания используют преимущественно свободные жирные кислоты (образуются при расщеплении триглицеридов жировой ткани) или кетоновые тела (образуются в печени при окислении свободных жирных кислот).
В состоянии покоя печень образует примерно 10 г глюкозы в час, при этом 65—75% этого количества - глюкагонзависимо. Головной мозг утилизирует около 6 г глюкозы в час независимо от инсулина. Если утилизация глюкозы периферическими тканями превышает 4 г в час, то продукция глюкозы печенью повышается благодаря усилению ее образования из гликогена (гликогенолиз) и из белков и жиров (глюконеогенез), тем самым, обеспечивая потребности инсулиннезависимых тканей организма (см. ниже), т.е. сохраняя необходимое количество глюкозы для этих тканей.
По отношению к инсулину все ткани нашего организма можно разбить на две группы:
1.Инсулиннезависимые
Клетки инсулиннезависимых тканей, это клетки, в которые глюкоза попадает вне зависимости от наличия инсулина методом простой диффузии (взаимного проникновения, самопроизвольного перемещения вещества из мест с большей их концентрацией в места с меньшей концентрацией вещества ). Количество диффундирующей в клетку глюкозы пропорционально коэффициенту диффузии, разности концентрации глюкозы внутри и снаружи клетки, площади мембраны и обратно пропорционально ее толщине. Диффундирует глюкоза по направлению градиента (вектора) концентрации глюкозы, т.е. из области внеклеточного пространства с высокой концентрацией глюкозы во внутриклеточную область с низкой концентрацией глюкозы. Единственным условием такого перемещения является меньшая концентрация глюкозы внутри клетки и большая концентрация за ее пределами, т.е. наличие разности концентраций глюкозы. Примером таких клеток являются клетки центральной нервной системы, в частности, в клетки головного мозга. Т.е. под «инсулиннезависимостью» этих клеток понимается лишь независимость транспорта глюкозы в эти клетки от инсулина и ничего более.
В настоящее время ряд исследований показал, что и эти ткани имеют инсулиновые рецепторы, участвующие в процессе поступления в глюкозы внутрь клеток этих тканей, но для простоты рассуждений не будем касаться их, считая их полностью инсулиннезависимыми. Мы не будем рассматривать эти ткани потому, что они напрямую независимы от гормона, дефицит которого является причиной сахарного диабета. Мы будем лишь иметь в виду, что таковые ткани есть, они нуждаются в глюкозе, как энергетическом субстрате и наша первейшая задача – обеспечить их этим субстратом.
2.Инсулинзависимые
Это клетки, функционирование которых зависит от инсулина либо на этапе проникновения глюкозы в них (мышечная и жировая ткани), либо на этапе внутриклеточных процессов (печеночная ткань) На них мы и остановим наше внимание.
Для начала несколько цифр :
Пул глюкозы, т.е. общее содержание свободной глюкозы в организме, составляет величину порядка 20 г. Из них 5 - 5,5 г содержится в крови, остальная глюкоза распределена в клетках и межклеточной жидкости. Из приведенных цифр следует, что концентрация глюкозы в клетках значительно ниже, чем в крови, что создает условия для поступления глюкозы из крови в клетки путем простой или облегченной диффузии. Порядка 25 % свободной глюкозы находится именно в крови, а 75 % приходится на миллиарды клеток с их межклеточным пространством.
А что такое 20 грамм свободной глюкозы, если учесть, что калорийность одного грамма составляет 4.1 килокалории ? Это сущий пустяк. Такого количества глюкозы не хватит на 20 минутную прогулку умеренным шагом или на «немного подумать над таинствами диабета». А это, в свою очередь, означает, что в организме должны быть механизмы, которые восполняют потраченную глюкозу. Это означает, что в организме должны существовать запасы глюкозы и механизмы, которые эти запасы создают. Вот эти механизмы накопления и расходования глюкозы и роль инсулина в них нас интересуют в первую очередь.
Разумеется, чтобы говорить о дальнейшей судьбе полученной нами с питанием ( из углеводов) глюкозы, нам надо обеспечить ее доступ в клетки инсулинзависимых тканей. Иначе она будет просто «гулять» по организму, вызывая гипергликемию. Этим обеспечением доступа в клетки занимается гормон инсулин.
Проникновение глюкозы в такие клетки происходит по механизму облегченной диффузии, т.е. с участием переносчиков. Основное действие инсулина заключается в усилении транспорта глюкозы через мембрану клеток инсулинзависимых тканей. Стимуляция инсулином приводит к увеличению скорости поступления глюкозы внутрь клетки примерно в 40 раз. Транспорт глюкозы через мембрану клетки осуществляется белками-транспортерами. При стимуляции инсулином наблюдается увеличение в 5-10 раз содержания транспортных белков глюкозы в плазматических мембранах при одновременном уменьшении на 50-60% их содержания во внутриклеточном пуле. Поэтому инсулин можно представить в роли своеобразного катализатора процесса попадания молекул глюкозы в клетки инсулинзависимых тканей или своеобразным «ключом двери» инсулинзависимой клетки. Образно его можно представить в роли «кучера», подающего «лошадей» (белки-транспортеры) к подъезду. Тех самых «лошадей», с помощью которых молекула глюкозы «въедет» в клетку, используя механизм упрощенной диффузии.
В пище содержатся моносахариды, дисахариды и полисахариды.
Моносахариды (в том числе — глюкоза) быстро всасываются в желудочно-кишечном тракте (ЖКТ) и поступают в кровь. Дисахариды и полисахариды предварительно расщепляются ферментами желудочно-кишечного тракта до моносахаридов. Поэтому после приема пищи, содержащей преимущественно ди- и полисахариды, концентрация глюкозы в крови повышается медленнее, чем после приема пищи, богатой глюкозой. Скорости повышения концентрации глюкозы в крови после потребления ди- и полисахаридов различаются незначительно, особенно если эти углеводы потребляют вместе с другими питательными веществами (жирами и белками). Повышение уровня глюкозы стимулирует секрецию инсулина бета-клетками островков поджелудочной железы. Инсулин через воротную вену поступает в печень, где разрушается примерно 50% гормона. Оставшийся инсулин поступает в общий кровоток, связывается с рецепторами тканей-мишеней и стимулирует поглощение глюкозы этими тканями. Главные мишени инсулина — клетки печени, мышц и жировой ткани.
Первым преобразованием поступившей в клетку глюкозы является ее превращение в особую активированную форму (глюкозо-6-фосфат). При этом убиваются сразу два зайца:
Во-первых, наружная клеточная мембрана непроницаема для этой активированной формы глюкозы и в результате такой операции глюкоза как бы «запирается» в клетке. Это своего рода «улица с односторонним движением»
Во-вторых, это позволяет поддерживать крайне низкую концентрацию собственно глюкозы в клетке, сохраняя тем самым градиент концентрации глюкозы между внеклеточной жидкостью и внутриклеточной средой. Ведь, строго говоря, эта активированная форма глюкозы, это уже и не совсем глюкоза. Она уже не будет влиять на разность концентрации собственно глюкозы внутри и за пределами клеток.
Ферментами, катализирующими эту реакцию, является гексокиназа и глюкокиназа. Существенным различием между этими ферментами является то, что первый способен превращать глюкозу в глюкозо-6-фосфат при низких ее концентрациях в клетках, а второй работает лишь в условиях высоких концентраций глюкозы в клетке и обычно принимает участие лишь в процессе синтеза гликогена в печени. И это тоже является одним из механизмов регулирования процессов депонирования (накопления) глюкозы в клетках и ее отдачи в различных режимах работы человеческого организма. По сути, эти два фермента выполняют роль «стрелочников», изменяющих направление потоков глюкозы в различных условиях жизнедеятельности организма.
Во время еды и ее усвоения, когда глюкозы много, на первый план встает вопрос ее депонирования. Причем депонирования в условиях ее высокой концентрации. На этом этапе возрастает роль глюкокиназы, работающей в печени. В перерывах между приемами пищи, когда содержание глюкозы низкое ( на тощаковом уровне) на первый план встает вопрос ее захвата другими тканями (к примеру, мышцами). И этому захвату как раз и способствует наличие гексокиназы, характерной для мышечной ткани.
Теперь зададимся вопросом: а что же дальше ? Какие же дальнейшие цели и задачи решает поступившая в клетки глюкоза ? Их условно можно разбить на три категории :
1.Использовать глюкозы по прямому назначению как энергетический субстрат ( «сжечь» с выделением энергии, необходимой клетке)
2.Отложить в запас практически в неизменном виде ( в виде гликогена)
3.Трансформировать в другие энергетические субстраты (жир) и также отложить в запас.
Все эти задачи решаются в клетках разных тканей по-разному.
Как говорилось выше, в инсулиннезависимых клетках глюкоза используется только по прямому назначению, как энергетический субстрат, подлежащий процессу «горения» (окисления с выделением энергии, необходимой этим клеткам). Об этих клетках речь шла выше и мы не будем дальше касаться их.
Есть клетки, которые могут хранить глюкозу в виде гликогена. Гликоген, как резерв глюкозы, накапливается в клетках во время пищеварения и расходуется в перерывах между приемами пищи. В данной книге нет смысла описывать сложные биохимические реакции превращения глюкозы в гликоген, приводить слова типа «гликозилтрансфераза» и прочие, которые у человека, не обремененного медицинским образованием, вызывают тоску вперемежку с чувством некоторой ущербности от сложности и «заумности» произносимых слов. У меня, во всяком случае, так.
Достаточно сказать, что синтез гликогена идет во многих органах и тканях, однако наибольшее содержание наблюдается в печени ( от 3-5% общей массы органа ) и в мышцах ( до 1 % от их массы ). Следует отметить и то, что инсулин напрямую в синтезе гликогена не участвует. Он лишь поставляет «сырье» для этого синтеза – глюкозу. Но это «лишь» является одним из ключевых моментов данного процесса. Если в клетках организма не будет «сырья», то и депонировать будет нечего.
Есть клетки, которые могут хранить глюкозу, трансформированную в другие энергетические субстраты. К примеру, в жир. Это клетки жировых тканей. На них остановимся позже.
Главное понять, что процесс приема пищи можно сравнить со «сбором урожая» и на этом этапе главная задача – сохранить этот урожай, складировать его в «закрома».
Для «технарей» этот процесс можно сравнить с зарядом аккумулятора. И на этом этапе нет, и не может быть более главной задачи, чем сохранить «урожай» (зарядить аккумулятор). Задачи, где главная роль отводится именно инсулину. Он не выращивает «урожай», но именно он обеспечивает его поставку в закрома.
Теперь рассмотрим обратный процесс – получение глюкозы, т.е. ее отпуск из накопленных запасов и поддержание ее нормальной концентрации в крови.
Как уже говорилось выше, этот процесс происходит благодаря механизмам гликогенолиза и глюконеогенеза. Но, в разное время и при разных условиях жизнедеятельности организма, роль и соотношение этих процессов в энергообеспечении организма различна.
К примеру, во время ночного голодания только 25% глюкозы образуется путем глюконеогенеза. Т.е. 75 % приходится именно на гликогенолиз. Другими словами, ночью человек живет в основном на «аккумуляторе», в роли которого выступает печень с запасом гликогена. Разумеется, чтобы обеспечить такой режим, надо иметь заряженный аккумулятор.
Из вышесказанного совершенно очевидно, что источником такого заряда может быть только пища. Причем пища, богатая углеводами, как прямым источником глюкозы. Дефицит углеводов в рационе питания приводит к недозаряду аккумулятора и вынуждает организм включать «генератор», в роли которого выступает процесс глюконеогенеза и кетогенеза. Кстати, увлечение различными малоуглеводистыми диетами приводит как раз к этому, что сопровождается наличием т.н. «голодного ацетона». Причем, это может происходить и в организме здорового человека.
Но совершенно очевидно и другое: мало иметь достаточное количество углеводов (глюкозы) в рационе. Надо иметь еще и отлаженную систему ее депонирования. Систему, в которой ключевую роль играет инсулин, дефицит которого также приводит к нарушению процессов депонирования глюкозы. Это приводит, с одной стороны, к увеличению ее содержания в крови (гипергликемия) с одновременной активизации процессов глюконеогенеза и кетогенеза, с констатацией наличия ацетона. Именно это и происходит при инсулиновой недостаточности. Особенно в предманифестационный период СД1, когда абсолютная инсулиновая недостаточность уже есть, но компенсаторная инсулинотерапия еще не назначена. Недаром при манифестации СД1 отмечается не только гипергликемия, но и кетоз (наличие повышенного количества кетоновых веществ)
Нарушение процесса заряда-разряда аккумулятора может происходить и на фоне инсулинотерапии при условии, что эта инсулинотерапия неадекватна и неточна. В этих условиях, условиях лабильного диабета, ацетон является частым «гостем» диабетика, переходя, в запущенных случаях, в диабетический кетоацидоз, приводящий к диабетической коме.
После пробуждения вклад гликогенолиза в общую продукцию глюкозы значительно снижается, и по мере удлинения периода голодания глюконеогенез все более преобладает над гликогенолизом. Другими словами во время бодрствования включаются механизмы «гликогеносбережения» и организм снабжается энергией из «альтернативных» источников за счет процессов глюконеогенеза (получение глюкозы из неуглеводных веществ) и сопутствующего ему процесса кетогенеза (образования кетоновых тел, как энергетического субстрата)
Это должно быть понятно любому автолюбителю. Ночью на стоянке все системы автомобиля (сигнализация, фары и подфарники, которые забыли выключить и т.д.) будут питаться за счет аккумулятора. А вот днем основным источником энергии является генератор, который снабжает энергией системы автомобиля, сохраняя при этом заряд аккумулятора. Иначе далеко не уедешь … Емкости аккумулятора просто не хватит.
Для того чтобы использовать накопленную в виде гликогена глюкозу надо выполнить две основных операции над гликогеном :
1.Превратить гликоген в то, из чего он, собственно, и образовался. Т.е. в активированную форму глюкозы (глюкозо-6-фосфат).
2.Превратить глюкозо-6-фосфат в собственно в глюкозу и сделать ее проницаемой через мембраны клеток, где она хранилась, включить ее в кровоток.
Первый процесс происходит под управлением фермента под названием фосфорилаза. Именно в результате работы этого фермента, работающего во всех клетках, в которых есть гликоген, и происходит процесс превращения гликогена в активированную форму глюкозы. Но, как было сказано выше, мембраны клеток непроницаемы для нее.
Превращение глюкозо-6-фосфата в собственно глюкозу происходит под управлением другого фермента под названием глюкозо-6-фосфатазы, который обеспечивает отщепление фосфатной группы и образование свободной глюкозы. Но с этим ферментом не все так просто. Оказывается, что в одних клетках он есть, а в других его нет. Т.е. в одних клетках образовавшаяся из гликогена глюкоза может выйти за пределы клетки в виде свободной и включиться в кровоток, а в других она так и остается «невыездной». Наличие или отсутствие этого фермента в клетках различных тканей определяет порядок перемещения глюкозы через мембрану клетки. Или этот процесс будет двусторонним, и глюкоза может перемещаться туда-сюда или это процесс будет односторонним и глюкоза может перемещаться только внутрь клетки
В большинстве органов и тканей человека фермент отсутствует, поэтому запасенный в них гликоген и получаемая из него глюкоза используются лишь для собственных нужд. Типичным представителем таких тканей является мышечная ткань.
В отличие от мышечной и прочих тканей, этот фермент имеется лишь в печени, почках и кишечнике, но наиболее существенным является его наличие в печени, точнее, в гепатоцитах, являющихся основными клетками печени (приблизительно 60% всех клеток).
Первичным сигналом, стимулирующим мобилизацию (расщепления) гликогена в печени, является снижение концентрации глюкозы в крови. В ответ на него альфа-клетки поджелудочной железы выбрасывают в кровь свой гормон - глюкагон. Глюкагон, циркулирующий в крови, взаимодействует со своим белком-рецептором, находящемся на внешней стороне наружной клеточной мембраны гепатоцита, образуя гормон-рецепторный комплекс. В результате ряда преобразований с участием различных ферментов включается механизм расщепление гликогена, и гепатоциты начинают поставлять глюкозу в кровь.
В отличие от печеночного, мышечный гликоген является источником глюкозы для самой клетки мышечной ткани, в то время как гликоген печени используется главным образом для поддержания физиологической концентрации глюкозы в крови.
Попутно следует отметить другое важное отличие клеток мышечной и печеночной ткани. Если в первые глюкоза попадает с помощью инсулина, то во вторые она попадает без инсулина. В этом плане печеночная ткань является инсулиннезависимой. Но инсулин работает в печени на внутриклеточном уровне ( о чем пойдет речь ниже). И в этом плане печень инсулинзависима.
Исходя из сказанного, единственным полноценным и значимым депо для хранения глюкозы с последующим снабжением ею тканей организма, является печень. Мышцы таким полноценным депо не являются. По сути дела, поведение мышечной ткани напоминает «прихватизацию», когда часть «общенародного достояния» (глюкозы) прихватывается для себя, любимого, без перспективы поделиться «приватизированной» глюкозой с другими. Печень в этом плане бескорыстней, поскольку цель ее приватизации как раз и заключается в том, чтобы поделиться накопленными богатствами с нуждающимися в «голодное время» ( в перерывах между приемами пищи).
Справедливости ради следует отметить, что мышцы не такие уж «жадины».
Во-первых, потому что при определенных условиях они могут поделиться глюкозой даже, несмотря на «глюкозо-6 фосфатный запрет». Это обусловлено следующим:
Окисление глюкозы может происходить в виде аэробного ( требующего кислород) окисления или в виде анаэробного (при недостатке кислорода) окисления. Аэробное окисление глюкозы, это предельное ее окисление до СО2 и Н2О, а анаэробное, это специфический путь, связанный с образованием лактата (молочной кислоты). Лактат с кровью поступает в печень, где вновь преобразуется в глюкозу. И вовсе не факт, что полученная из лактата глюкоза попадет обратно в мышцы. Она будет использоваться там, где нужнее. Это своего рода «налог» за приватизированное достояние.
Аэробное и анаэробное окисление энергетически неравноценны. Аэробное окисление обладает существенно бОльшим энергетическим эффектом, нежели анаэробное, при котором мышцы, ограничивая себя в энергии, дают возможность другим органам дополучить необходимую им глюкозу.
Потеря мышцами энергетического субстрата в виде глюкозы должно быть скомпенсировано поступлением в них других энергетических субстратов. К примеру, тех, которые образуются при глюконеогенезе (см. ниже). Физические нагрузки стимулируют процесс глюконеогенеза. И здесь вновь появляется вездесущий инсулин. Он не управляет поступлением этих субстратов в клетки мышечной ткани. Он поступает мудрее – регулирует сам процесс глюконеогенеза, держа его в «узде».
Во-вторых, мышцы являются депо для хранения другого энергетического субстрата – аминокислот, о которых речь пойдет ниже.
Основными физиологическими стимулами секреции глюкагона у здорового человека служит белковая пища, инфузия аминокислот и физическая нагрузка, особенно если она велика или длительна. Именно эти воздействия изменяют относительно постоянный уровень секреции глюкагона, как одного из управляющих плечей нашей САУ (см. последний параграф данной главы). Соответственно, они должны влиять и на адекватное количество секреции инсулина с целью сохранения нужного баланса между двумя этими гормонами. Причем, в разных случаях по-разному. В одних случаях (при приеме белковой пищи) за счет количества секретируемого инсулина, а в других случаях (при физических нагрузках) за счет повышения эффективности его действия при тех же и даже меньших количествах.
Попутно следует упомянуть и о роли такого контринсулярного гормона, как адреналин, о котором говорилось выше при рассмотрении схемы защиты от гипогликемии. Адреналин связывается с соответствующими рецепторами гепатоцитов, что в свою очередь активирует фосфорилазу, о которой шла речь выше. Это, в свою очередь, усиливает расщепление гликогена. Следует заметить, что высокие концентрации адреналина, наблюдающиеся в крови людей в условиях эмоционального стресса, ускоряют расщепление гликогена в печени, повышая тем самым содержание глюкозы в крови - защитная реакция, направленная на экстренную мобилизацию энергетических ресурсов. Аналогичная защита срабатывает и у диабетика при стремительном и глубоком понижении уровня глюкозы в крови, приводящем к гипогликемии. Правда, зачастую срабатывание этой схемы защиты приводит к последующему «откату» или постгипогликемической гипергликемии. В случае повышения концентрации глюкозы крови включаются механизмы снижения фосфорилазной активности в гепатоцитах. И определенную роль в этом играет все тот же инсулин. Его связывание с инсулиновыми рецепторами на поверхности гепатоцитов приводит к снижению указанной фосфорилазной активации и создает условия для синтеза гликогена из глюкозы (создания запасов гликогена). Вот в этом и заключается работа инсулина в печени на внутриклеточном уровне, о чем говорилось выше.
Теперь настала пора поговорить о том, куда же девается глюкоза кроме как ее депонирования в виде гликогена ? Ведь в печени взрослого человека содержится в среднем 300-400 г гликогена, что дает 1200-1600 ккал. Количество гликогена в мышцах составляет до 1 % мышечной массы. Соответственно, можно подсчитать количество гликогена.
Из сказанного совершенно очевидно, что емкость гликогеновых депо ограничена. Оно и понятно. Чтобы сделать серьезные энергетические запасы в виде вещества, калорийность одного грамма которого всего 4.1 ккал, надо это вещества очень много. Да, это мобильное топливо, но никаких других функций оно в организме не несет. Разумней было бы превратить его в другое вещество, с большей калорийностью и несущее какие-то дополнительные функции, кроме запаса топлива. К примеру, защитные, теплоизоляционные, пластические и т.д. И такое вещество есть - жир. Вот все излишки поступившей с пищей глюкозы и превращается в жир. Надо сказать, что объемы жировых запасов безразмерны. Они ограничены лишь размером брючного ремня или воротника рубашки и способностью человека носить на себе эти запасы без последствий для своего здоровья.
Опять несколько цифр :
Калорийность 1 грамма жира составляет 9.3 ккал. Если принять, что в среднем у человека 15 кг жира, то это почти 140 000 ккал. При средних затратах в день 3000 ккал, этого хватит примерно на 40 дней. Процесс превращения глюкозы в жир происходит в клетках жировых тканей, куда она попадает под контролем инсулина по аналогии с клетками мышечных тканей. Исходя их из этого клетки жировой ткани в полной мере инсулинзависимы. Эти процессы мы рассмотрим в следующих главах.
Общая схема гомеостаза глюкозы приведена на рисунке 2.1 :
Говоря об углеводах, было бы ошибкой не упомянуть и о фруктозе. Той самой, которую рекомендуют диабетикам, поскольку, якобы, путь ее утилизации не зависим от инсулина и она, якобы, не повышает уровень глюкозы в крови. Это не так. Просто у попавшей в организм (в кровь) фруктозы разная «судьба» и разные механизмы метаболизма, чем у попавшей с пищей глюкозы.
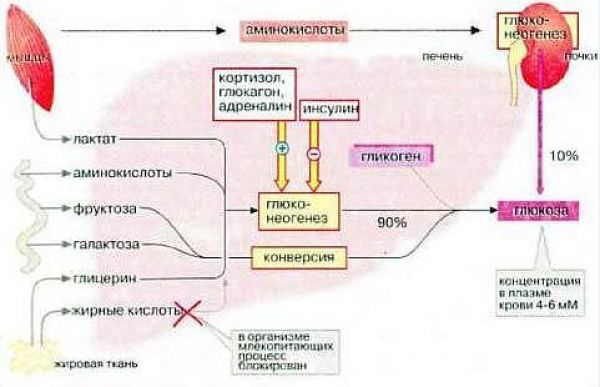
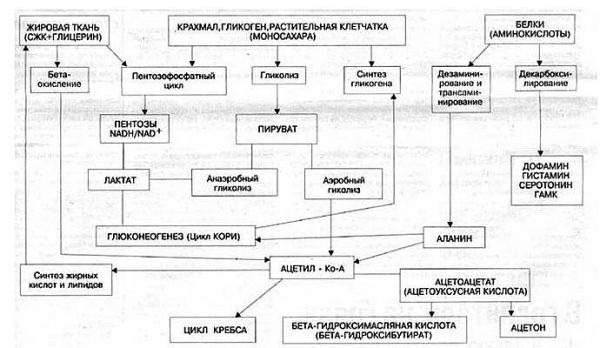
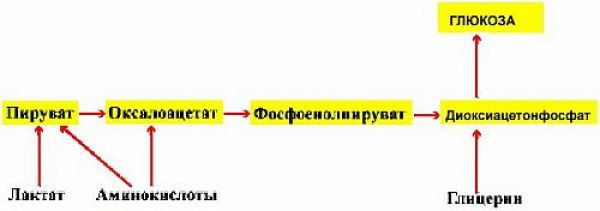
На начальном этапе их «судьбы» совпадают. И та и другая в основной своей массе задерживаются в печени и этот процесс (процесс попадания в печень) действительно инсулинонезависим (см. выше). Но если попавшая в печень глюкоза используется по своему прямому назначению ( создание запасов гликогена) и этот процесс инсулинзависим на клеточном уровне, то фруктоза путем конверсии ( изменения, превращения) превращается в глюкозу, которая, затем, используется в процессах накопления глюкагона, т.е. в инсулинзависимых процессах. Это наглядно видно на рисунке 2.2
Это, в свою очередь, означает, что фруктоза прямо влияет на количество глюкозы в организме, а, следовательно, подлежит компенсации. Просто процесс превращения фруктозы в глюкозу занимает какое-то время. Это и объясняет то, что фруктоза медленно повышает уровень глюкозы в организме, что соответствует ее низкому гликемическому индексу ( см. далее )
Белковый обмен и сахарный диабет
Белки пищи являются источником столь необходимых организму аминокислот. Белки переводятся в доступную для организма форму при переваривании под действием ферментов, входящих в состав желудочно-кишечных секретов. Свободные аминокислоты всасываются и после транспорта кровью включаются в клетках в различные пути использования, главным из которых является синтез собственных белков.
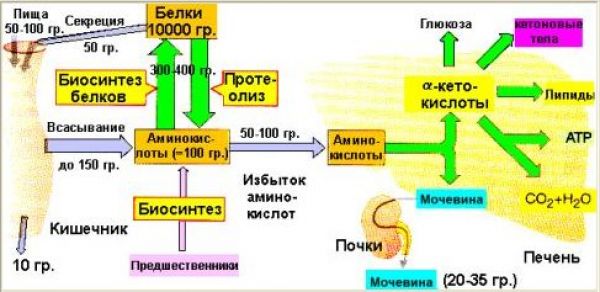
Кроме того, аминокислоты используются для синтеза других азотсодержащих соединений, например таких, как тироксин, адреналин, гистамин, выполняющих специфические функции. Аминокислоты используются также как источники энергии. Пути использования аминокислот представлены на рисунке 2.3 :
Из рисунка видно, что избыточные аминокислоты, образовавшиеся из поступивших с пищей белков, включаются в процессы глюконеогенеза и другие процессы, подпадающие под «юрисдикцию» инсулина. Из этого можно сделать вывод о том, что процесс утилизации излишних белков инсулинзависим. Но уместен вопрос: это касается только излишних белков или инсулинозависим весь процесс утилизации белков ? Т.е. инсулинзависим ли процесс, когда в пище «белки не лишние, а в самый раз» ? Инсулинзависимы ли процессы левой части рисунка ?
В этом «труде» нет смысла описывать сложнейшие процессы усвоения пищевых белков, образования аминокислот и их участие в синтезе белков. Конечно, можно все это расписать, ссылаясь на труды профессиональных биохимиков. Но надо ли ? Нам, диабетикам, достаточно взглянуть на следующий рисунок, чтобы понять: да, зависимы. Это отражается в одной из веток («Синтез белков») работы такого многофункционального гормона, каким является инсулин. См. Рисунок 2.4
Выраженный дефицит инсулина сопровождается отрицательным азотистым балансом и резким белковым истощением. Такие нарушения не вызывают удивления, ибо инсулин, если он присутствует в нормальных количествах, стимулирует синтез белка, поглощение аминокислот мышцами, тормозит расход белка и высвобождение аминокислот мышечной тканью. Отклонения белкового обмена сказываются и на глюконеогенезе (получение глюкозы) из белка, поскольку избыточная продукция глюкозы при диабете, сопровождающемся кетозом, отчасти зависит от повышения утилизации образующихся из белка предшественников.
Глюконеогенез из белка (аминокислот) в организме здорового человека происходит в печени постоянно, поскольку аминокислоты тоже являются энергетическим субстратом. Глюконеогенез из белка составляет 15-20 % от общей продукции глюкозы печенью, в то время как у диабетика он может значительно увеличиться. Разумеется, у декомпенсированного диабетика, не подозревающего о том, что белковый обмен инсулинзависим.
У больных диабетом количество азотистых продуктов в мышцах после приема белковой пищи восстанавливается труднее, чем в норме. Вследствие этого снижается общее поглощение аминокислот мышцами, а уровень аминокислот в плазме после приема белковой пищи чрезмерно повышается. Это согласуется с известным стимулирующим влиянием инсулина на поглощение мышцами аминокислот. Нарушения белкового обмена при диабете усугубляются тем, что аминокислоты, захваченные мышечной тканью, не включаются в белок, а преимущественно распадаются
Торможение синтеза белка из аминокислот является предпосылкой для образования из них углеводов. При сахарном диабете образование углеводов из белка (глюконеогенез), значительно увеличивается.
В процессе превращения белка в углеводы образуется аммиак, мочевина и другие продукты распада. В связи с этим, при нелеченном или декомпенсированном СД возникают процессы, обусловленные усиленным образованием аммиака, как в печени, так и в почках.
Уже только это наводит на мысль о инсулинзависимости белкового обмена и необходимости компенсировать прием белков, поступающих с пищей. Вопрос даже не стоит так: повышают ли белки уровень глюкозы крови ? Это вообще не вопрос, поскольку любой диабетик может ответить на него с помощью куска мяса и глюкометра. Вопрос должен стоять шире: нужна ли в условиях недостаточности инсулина компенсация инсулинзависимого белкового обмена ? Нужна ли компенсация пищевого белка с целью его правильного и полного включения в этот обмен ?
Ведь многие составляющие белкового обмена протекают вне зависимости от углеводного обмена. Т.е. наличие нормального уровня глюкозы в крови как показатель нормального углеводного обмена вовсе не означает, что белковый и жировой обмен в условиях дефицита инсулина протекают нормально. А это значит, что дефицит инсулина должен компенсироваться и в белковом обмене, а не только в углеводном. Кроме того, все выделяемые три вида обмена веществ взаимозависимы в организме: изменение одного из них не может не сказаться на двух других, тем или иным образом. Например, глюконеогенез (в частности, образование в печени углеводов из аминокислот), который регулирует инсулин, отражает тесную связь между обменом белков и углеводов в организме. При такой взаимозависимости обменов веществ их разделение на «главный и второстепенные» выглядит неестественным
А сколько же пищевых белков и образующихся из них аминокислот, попадающих в организм с пищей, непосредственно превращаются в углеводы (глюкозу), включаясь в процесс глюконеогенеза ? Т.е. каков процент аминокислот, поступающих непосредственно из ЖКТ, включается в процесс, изображенный на рисунке 2.2 ? Не мне, дилетанту, оценивать это. Лучше обращусь к первоисточнику и приведу цитату: «… до 50 % белковых веществ растительного и животного происхождения инсулин способен превращать в углеводы. И это обстоятельство учитывается при расчете нужной диеты для больных сахарным диабетом, а также при подборе нужной дозы инсулина и других сахароснижающих препаратов. Кроме глюкозы, и другие биологические соединения, поступающие в наш организм с пищей, влияют на регуляцию синтеза и выделения в кровеносное русло инсулина. Это относится и к белковым, и к жировым компонентам пищи. Кстати, практически половина поступающих в наш организм белков (главным образом за счет мяса, рыбы, птицы и некоторых продуктов растительного происхождения ) превращаются в углеводы. В здоровом организме 50 % белковых веществ, попадающих в организм с пищей, превращаются в углеводы».
И это пишет врач-диабетолог высшей квалификации, кандидат медицинских наук, имеющий более чем 40-летний опыт практической диабетологии. Можно говорить о проценте этих превращений: 50 % или меньше или больше. Но об этом пусть говорят между собой профессионалы. Меня, как диабетика, интересует лишь практическая сторона вопроса компенсации пищевых белков, и об этом я буду говорить в следующих главах.
Кроме того, на усвоение белка организму требуется много энергии. Белки – высокомолекулярные соединения, состоящие из нескольких сотен аминокислот. Для усвоения и использования белка необходимо расщепить его на короткие аминокислотные цепочки или сами аминокислоты. Это – длительный процесс. Проходит он на протяжении всего движения белковой пищи по ЖКТ и требует много различных ферментов, которые организм должен синтезировать и направить в ЖКТ. Все это в сумме требует большое количество энергии на усвоение белковой пищи. Поэтому во время приема белковой пищи ускоряется метаболизм и увеличиваются затраты энергии на внутренние процессы. Поэтому для усвоения белков организм использует энергию в первую очередь из углеводов (глюкозы). А если ее не хватает, то из жиров. Но это в свою очередь требует дополнительные регулирующие действия инсулина. Следовательно, сам процесс усвоения белков в этом отношении инсулинзависим. Достаточное количество белка в рационе питания обеспечивает увеличение энергии на основной обмен на 18–20 %. Максимальное увеличение основного обмена после приема белковой пищи наступает через 3-5 часов после приема. Вот почему сахароповышающий эффект белковой пищи такой длительный и поздний. Об этом еще пойдет речь дальше при составлении формулы расчета компенсационной дозы инсулина.
В этом случае борются между собой как бы две тенденции: с одной стороны – стремление как можно больше белков (аминокислот) включить в процесс глюконеогенеза для получения необходимой глюкозы, с другой стороны – притормозить этот процесс с целью сохранения драгоценных белков. Это не может не привести к влиянию белковой пищи на секрецию управляющих воздействий в САУ, сохранению оптимального баланса между двумя указанными тенденциями.
Жировой обмен и сахарный диабет
Жировой обмен — совокупность процессов переваривания и всасывания нейтральных жиров (триглицеридов) и продуктов их распада в желудочно-кишечном тракте, промежуточного обмена жиров и жирных кислот и выведение жиров, а также продуктов их обмена из организма. Понятия «жировой обмен» и «липидный обмен» часто используются как синонимы, т.к. входящие в состав тканей животных и растений входят нейтральные жиры и жироподобные соединения, объединяются под общим названием липиды.
Жиры, как и гликоген, являются формами депонирования энергетического материала. Причем жиры - наиболее долговременные и более эффективные источники энергии. При голодании запасы жира у человека истощаются за 5-7 недель, тогда как гликоген полностью расходуется примерно за сутки. Если поступление жира превышает потребности организма в энергии, то жир депонируется в специализированных клетках жировой ткани. Кроме того, если количество поступающих углеводов больше, чем надо для депонирования в виде гликогена, то часть глюкозы также превращается в жиры. Таким образом, жиры в жировой ткани накапливаются в результате трех процессов:
1. поступают из экзогенных жиров пищи 2. поступают из эндогенных жиров, синтезированных в печени из глюкозы 3. образуются из глюкозы в самих клетках жировой ткани.
В организм взрослого человека с пищей ежесуточно поступает в среднем 70 г жиров животного и растительного происхождения. Здесь нет смысла раскрывать сложные процессы преобразований поступивших с пищей жиров с участием различных ферментов и желчной кислоты. Достаточно сказать, что конечным итогом этих преобразований является образование триглицеридов жировой ткани. В первом и втором случае этот синтез может протекать только в присутствии глюкозы. Инсулин стимулирует этот синтез, потому что в его присутствии повышается проницаемость мембран клеток жировой ткани для глюкозы. Т.е. процесс усвоения экзогенных и эндогенных жиров в жировой ткани является инсулинозависимым процессом. Проще говоря, для того, чтобы съеденный шмат сала правильно «улегся», нужна еще и глюкоза и нужен инсулин, чтобы она попала в клетки жировой ткани. При этом не имеет значения, откуда будет взята эта глюкоза. Из куска хлеба, съеденного с салом или из внутренних депо организма (при употреблении сала без хлеба). Т.е. процесс образования триглицеридов происходит с участием глюкозы. Той самой, уровень содержания которой регулируется автоматикой с участием того же вездесущего инсулина. Т.е. процесс усвоения и трансформации пищевых жиров происходит в присутствии инсулина и является инсулинозависимым процессом. Ну а третий процесс (процесс образования жиров из глюкозы) сам по себе является инсулинзависимым, поскольку для проникновения глюкозы в клетки инсулинзависимой жировой ткани инсулин нужен по определению.
В жировой ткани человека содержится большое количество жира, преимущественно в виде триглицеридов, которые выполняют в обмене жиров такую же функцию, как гликоген печени в обмене углеводов. Запасы триглицеридов могут потребляться при голодании, физической работе и других состояниях, требующих большой затраты энергии.
Мобилизацию депонированных жиров (липолиз) катализирует фермент под названием липаза. В результате жиры распадаются на глицерин и свободные жирные кислоты, которые из жировой ткани поступают в кровоток. Судьба жирных кислот в самой жировой ткани во многом зависит от содержания в ней глюкозы или, что более точно, от интенсивности протекающего в ней гликолиза. При голодании, когда содержание глюкозы в жировой ткани понижено, освободившиеся жирные кислоты не могут быть использованы жировой тканью для ресинтеза триглицеридов, и поэтому они быстро покидают эту ткань. Т.о., активация гликолиза в жировой ткани является фактором, способствующим накоплению в ней триглицеридов, а угнетение гликолиза, наоборот, способствует их удалению.
Глицерин транспортируется в печень, где используется в реакциях глюконеогенеза. Жирные кислоты транспортируются кровью в разные органы и ткани, где включаются в процесс окисления.
Другими словами, жировой обмен тесно связан с углеводным обменом и инсулинозависим. Дефицит инсулина приводит к ослаблению накопления жира в жировых депо и активизирует их расщепление на глицерин и жирные кислоты
Какова же дальнейшая судьба глицерина и жирных кислот, полученных в результате расщепления жира ?
Глицерин включается в процесс глюконеогенеза (получение глюкозы из неуглеводных соединений ). Это т.н. «глюконеогенез из жира».
Жирные кислоты с током крови попадают в органы и ткани, где подвергаются окислению. Около 30% жирных кислот задерживается в печени уже при однократном прохождении через нее крови. Некоторое количество жирных кислот, не использованных для синтеза триглицеридов, окисляется в печени до кетоновых тел, которые, не подвергаясь дальнейшим превращениям в печени, попадают с током крови в другие органы и ткани (мышцы, сердце и др.), где окисляются до СО2 и Н2О. Т.о. жирные кислоты и кетоновые тела являются энергетическим субстратом.
Небольшая часть мобилизованных жирных кислот используется в различных тканях для получения холестерина и других соединений
Кетоновые тела, это группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. К кетоновым телам относят b-оксимасляную и ацетоуксусную кислоты и ацетон, имеющие сходное строение и способные к взаимопревращениям. Появление повышенных количеств кетоновых тел в крови и моче является важным диагностическим признаком, свидетельствующим о нарушении углеводного и жирового обменов. Усиленное образование кетоновых тел приводит к метаболическому ацидозу (кетоацидозу), отравлению организма, диабетической коме и смерти.
Интенсивность образования кетоновых тел (кетогенез) и скорость их поглощения кетокислот тканями - величины крайне переменчивые, индивидуальные, не прогнозируемые и поэтому плохо поддающиеся количественной оценке.
Следует отметить, что кетогенез и умеренный кетоз (наличие кетоновых веществ) изначально представляют собой не патологическое расстройство энергетического обмена, а компенсаторно-приспособительную реакцию. Вместе с тем, усиленный и несдерживаемый кетогенез может привести к переходу от умеренного и нормального кетоза в кетоацидоз, который, как и любая форма ацидоза, является патологическим состоянием, а именно формой нарушения кислотно-щелочного состояния организма, когда он сдвигается в сторону увеличения анионов. По определению, ацидоз - лабораторный термин. Его критериями служат рН крови ниже 7,35, при концентрации стандартного бикарбоната сыворотки крови менее 18 ммоль/л. В норме анионная разница сыворотки крови не превышает 14 ммоль/л, а при кетоацидозе увеличивается до 15-20 ммоль/л.
Имеется множество ситуаций, сопровождаемых развитием кетоза и кетоацидоза и перехода кетоза в кетоацидоз. При сахарном диабете 1-го типа весьма распространенной причиной кетоацидоза (приводящего к диабетической коме) является нехватка инсулина, как следствие плохой компенсации сахарного диабета.
Увеличение концентрации глюкозы в жировой ткани и повышение скорости гликолиза угнетают липолиз. Повышение концентрации глюкозы в крови стимулирует секрецию инсулина, что также приводит к угнетению липолиза. Т.о., когда в организм поступает достаточное количество углеводов и скорость их расщепления высока, мобилизация жирных кислот и их окисление идут с пониженной скоростью. Как только запасы углеводов истощаются, и снижается интенсивность гликолиза, происходит усиление липолиза, в результате чего ткани получают повышенные количества жирных кислот для окисления. Вместе с тем повышение содержания жирных кислот в крови вызывает понижение интенсивности утилизации и окисления глюкозы, например в мышцах. Все это свидетельствует о том, что жировой и углеводный обмены, являющиеся главными энергообразующими процессами в организме, настолько тесно связаны друг с другом, что многие факторы, влияющие на один вид обмена, прямо или косвенно сказываются на другом.
И опять в этих процессах явно просматривается руководящая роль инсулина. С Одной стороны инсулин способствует депонированию жиров, с другой стороны глюкагон ( с помощью адреналина) способствует мобилизации депонированных жиров, включая их в процесс глюконеогенеза и кетогенеза.
Обмен веществ с точки зрения энергообеспечения организма
Как указывалось выше, содержание глюкозы в крови и межклеточном пространстве слишком мало, чтобы обеспечить потребности организма в энергии. Содержать же большее количество глюкозы в крови просто нецелесообразно.
Во-первых, потому, что это привело бы к изменению требований к самой конструкции кровеносной системы. (см. главу про САУ)
Во-вторых, нецелесообразно иметь большие запасы глюкозы в крови просто на всякий случай. Намного выгодней иметь ее запасы в каком-то другом виде, но при этом иметь надежную автоматику, обеспечивающую ее поступление в кровь при необходимости при различных режимах энергетической потребности организма.
В организме человека имеется три таких запаса (склада) «топлива» : гликоген, белки (аминокислоты) и жиры. Образование этих запасов мы уже рассматривали. Осталось лишь закончить их рассмотрение с точки зрения расходования.
Если говорить о количественной стороне, то можно сказать следующее :
1.Общие запасы гликогена (печень+мышцы) реально оцениваются величиной 500-700 граммов, что соответствует примерно 2000-3000 ккал. Кому-то таких энергетических запасов хватит на день, кому-то – на два, а сталевару или молотобойцу – лишь на рабочую смену. Биологическая целесообразность отводит гликогену последнее место в рейтинге запасных энергосубстратов. Во-первых, потому, что гликоген в организме никаких других функций, кроме энергетических, не имеет. Во-вторых, гликоген, трудно стабилизировать, то есть сохранять в живой ткани, причем для хранения требуется большое количество воды, что сильно снижает энергоемкость гликогена, которая и без того меньше, чем у белка и жира.
2. Наибольшим энергетическим потенциалом обладают белки мышц. У взрослого человека их общая масса достигает 35-40 кг, что эквивалентно 150-170 тыс. ккал. Но по понятным причинам использовать в качестве источника энергии собственные, белки крайне нежелательно. Разве можно в здравом уме постоянно отапливаться мебелью или силовыми конструкциями дома ?
3. В итоге самым оптимальным способом запасания энергии является синтез и отложение жира. По всей видимости, именно в этом кроется главная причина большой распространенности ожирения среди людей. Количество жировой ткани у взрослого человека – величина очень индивидуальная и вариабельная. По приблизительным подсчетам, масса жировой ткани у человека средней упитанности составляет около 15 кг. С учетом высокой энергоемкости (9 ккал на 1 г) общая энергетическая ценность этого количества жира практически не уступает энергоемкости белков тела. При этом жировая ткань выполняет в организме множество других важных функций: синтез и метаболизм гормонов, теплоизоляция, пластические функции, защитные функции от механических воздействий и многое другое. Таким образом, у человека есть веские основания «заботиться» о поддержании жировых запасов. И не случайно система регуляции энергетического обмена в большей мере ориентирована на создание запасов жира, чем на их растрату. Такой приоритет является существенной причиной большой частоты ожирения и того, почему с ним так трудно бороться.
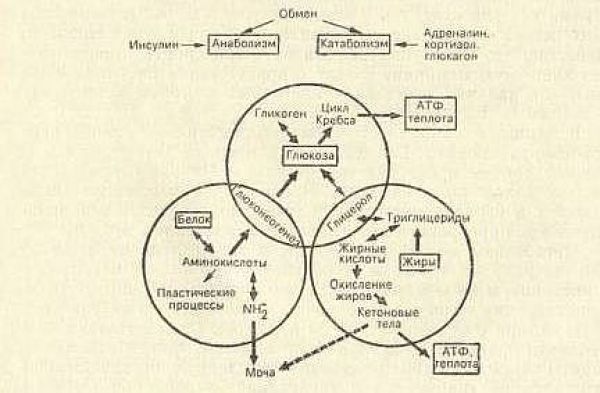
Принципиальная схема энергетического обмена представлена на рисунке 2.5 :
Упрощенная схема представлена на рисунке 2.6 :
И опять в этих процессах явно просматривается руководящая роль инсулина. С одной стороны инсулин способствует депонированию жиров, с другой стороны глюкагон способствует мобилизации депонированных жиров, включая их в процесс глюконеогенеза и кетогенеза.
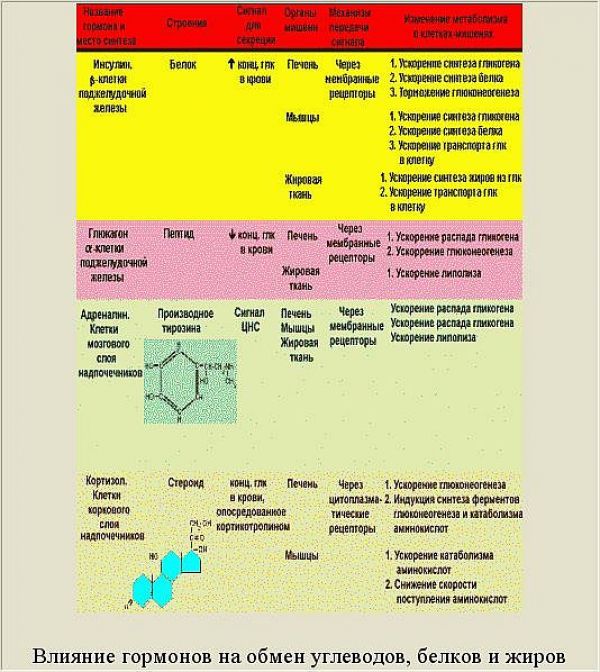
Надо сказать, что в работе этой сложнейшей САУ принимают участие не только инсулин и глюкагон, но и другие гормоны. Причем, по своему участию они являются контринсулярными. Другими словами, инсулину противодействует целая группа гормонов. Их участие показано на рисунке 2.7 :
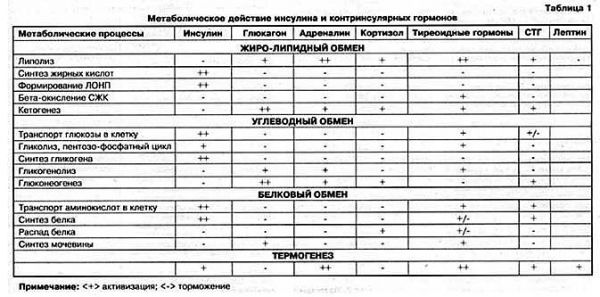
Роль инсулина и контринсулярных гормонов в этих процессах представлена в таблице
Анализируя схему и таблицу, следует выделить два ключевых момента.
Во-первых, энергообмен условно делится на накопительную (синтез жира и гликогена) и расходную фазу (гликолиз, окисление жирных кислот, мобилизация аминокислот). При этом главным стимулятором анаболической части обмена является инсулин, в то время как процессы расхода регулируют (точнее, усиливают) многочисленные контринсулярные гормоны.
Во-вторых, ключевым субстратом энергетического обмена и одновременно исходной субстанцией для синтеза кетокислот служит ацетил-КоА. Именно его содержание определяет направление клеточного метаболизма в данный момент, а именно: накопление или расходование. А это в первую очередь зависит от количества пищи, поступающей в организм. Если пищи много и ее количество превышает текущие энергозатраты, часть пищевых энергоносителей преобразуется в гликоген и жир. Причем, преимущественно в жир, так как запасы гликогена, как уже отмечалось, невелики, и этот «склад» быстро наполняется. Если пищи мало или ее нет, организм восполняет дефицит, расходуя ранее сделанные запасы - сначала гликоген, затем белки, затем жир. Поскольку гликогена мало, а белки слишком ценны, чтобы ими постоянно «топить», основным источником энергии в условиях голодания является жир.
Из приведенной таблицы ясно, что :
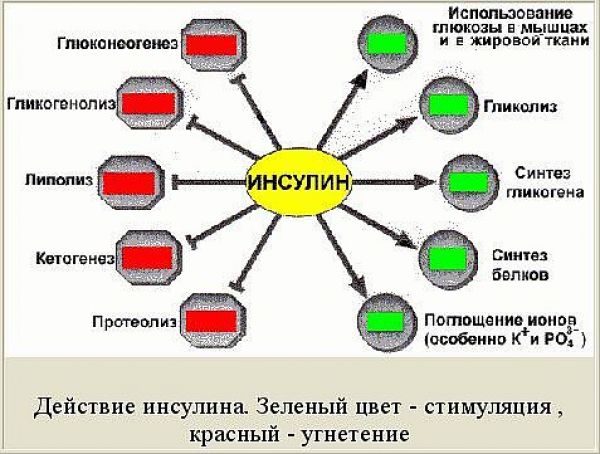
Инсулин является анаболическим гормоном, усиливающим синтез углеводов, белков и жира. Осуществляет утилизацию, метаболизм и «складирование» поступающих в организм пищевых веществ и имеет следующие функции :
Углеводный обмен
1.Увеличение утилизации глюкозы мышцами и жировой тканью. 2.Увеличение синтеза гликогена печенью и мышцами. 3.Повышение фосфорилированной глюкозы 4.Усиление гликолиза (превращение глюкозы в молочную кислоту и снабжение организма энергией в течение короткого промежутка времени, когда организму не хватает кислорода, например, во время энергичной работы мышц). 5.Уменьшение глюконеогинеза (синтез глюкозы из жира и аминокислот) 6.Уменьшение гликогенолиза ( получение глюкозы из гликогена)
Жировой обмен
1.Повышение липогенеза (превращение глюкозы и углеводов в жирные кислоты ) 2.Увеличение синтеза жирных кислот и их превращение триглицериды. 3.Уменьшение липолиза, процесса расщепления липидов (особенно содержащихся в жире триглицсридов) на составляющие их жирные. 4.Уменьшение кетогенеза ( образование кетоновых тел, являющихся нормальным продуктом метаболизма жиров и могущих быть использованными для энергообеспечения организма ). В случае образования избыточного количества кетоновых тел у человека может развиться кетоз и кетоацидоз. Роль инсулина как раз и сводится к недопущению последнего.
Белковый обмен
1.Увеличение анаболизма белка (совокупность химических процессов, составляющих одну из сторон обмена веществ в организме, направленных на образование составных частей клеток и тканей) 2.Увеличение поглощения аминокислот. 3.Увеличение синтеза белка. 4.Уменьшение катаболизма белка (химическая реакция разложения сложных веществ в организме на простые, сопровождающаяся выделением энергии.)
Вопросы энергоснабжения автоматика решает двумя альтернативными способами:
1.Глюконеогенез, т.е. образование глюкозы из неуглеводных веществ (белки и жиры)
При этом:
А) Глюкозу можно получить из глицерина, входящего в состав жиров. Однако глицерин составляет лишь малую часть того, что получается при расщеплении жиров. В основном в результате расщепления жиров получаются различные жирные кислоты, из которых получаются кетоновые тела, в свою очередь также являющиеся энергетическим субстратом.
Б) Сырьем для производства глюкозы служат белки. Точнее, набор из 10, так называемых гликогенных аминокислот.
2.Синтез кетоновых веществ, которые являются альтернативным глюкозе источником энергии. Если посмотреть на схему, то видно, что кетоновые вещества являются продуктом - это продукт метаболизма ацетил-КоА, который при дефиците пищи образуется либо из собственных белков, либо из жира.
Жировая ткань представляет собой глицерин с прикрепленными цепочками жирных кислот. Из глицерина в процессе глюконеогенеза образуется глюкоза, а из жирных кислот в процессе кетогенеза образуются кетоновые вещества, как источник энергии.
Одновременно, глюкоза в процессе глюконеогенеза образуется и из аминокислот (глюканеогенез из белков) и из лактата (глюконеогенез из лактата).
Разумеется, в реальной жизни с ее переменными динамическими нагрузками, с ее реалиями в вопросах питания и т.д. все эти процессы энергоснабжения протекают параллельно. В одних случаях превалирует один, в других – другой и т.д. Здесь нет смысла рассматривать все это в реальном многообразии. Мы ведь говорим лишь об инсулине и его недостаточности, как причине сахарного диабета. Ну а роль инсулина в этих процессах видна в таблице 2.1.
Причем, здесь надо учитывать и «антагонистическую» функцию инсулина в системе автоматического управления. Поэтому знаки «+» и «-» надо рассматривать не только и не столько, как «участвует» или «не участвует», а как «активизирует» или «тормозит».
Если, к примеру, глюкагон активизирует процесс кетогенеза, то инсулин его тормозит, спасая человека от неуправляемого кетогенеза и последующей диабетической комы и смерти. В этом и проявляется участие гормонов в системе автоматического управления с отрицательной обратной связью, как управляющих воздействий. Эту систему нельзя рассматривать лишь в плане «накопление глюкозы – расход глюкозы». Она шире, многогранней и сложнее. Соответственно и роль инсулина надо рассматривать шире, чем элементарное «пропустить глюкозу в клетку». Чтобы оценить роль инсулина и инсулиновой недостаточности во всей их «красе» ограничиваться такой примитивной ролью инсулина нельзя. Хотя, для первого знакомства можно. Но лишь для первого. Для такого, какой был в первой главе на примере «кочегарки». Сейчас пора познакомиться с работой «кочегарки» более подробно.
Клетку ( к примеру, мышечной ткани) можно условно представить в виде маленькой печки, в которую подбрасывают дрова (глюкозу), иначе она погаснет (клетка погибнет). Причем, дрова не бросают сразу в огонь, а на некоторое время складируют перед топкой (гликоген мышц). Всю совокупность этих клеток представим в виде «кочегарки». Другие инсулинзависимые клетки организма (клетки печени и клетки жировой ткани) представим своеобразными складами топлива. Причем разного топлива. Глюкозу мы представим в виде сухих дров, а жир – в виде угля.
Как говорилось выше, у нас есть еще один вид топлива – аминокислоты, хранящиеся в мышцах. Назовем их условно «бревнами». Но поскольку аминокислоты играют особую роль в организме, то топить ими, это верх расточительности и бесхозяйственности. Это все равно, что топить мебелью или силовыми конструкциями кочегарки ( стропила, перекрытия и т.д.) Топить таким топливом можно лишь от безысходности или тогда, когда его слишком много ( старой мебелью, к примеру, или лишними балками, которые завезены для ремонта, но так и не понадобились). А теперь зададимся вопросом: а чем лучше топить ? Напрашивается ответ: конечно сухими дровами. И горят хорошо и уютно и не дымят и т.д. Но проблема в том, что их немного. Быстро сгорят, а дальше ?
Дальше взгляд останавливается на бревнах. А что ? Их много, да и горят неплохо. Ну и что из того, что они являются силовыми конструкциями ? Если их много, то чего и не потопить ? Ну, хотя бы ради экономии сухих дров. Правда, их надо еще «попилить-порубить», т.е. в процессе глюконеогенеза обратить их в готовые для употребления дрова. Ну и, заодно, убрать всякий «мусор». Аммиак всякий и прочее. Так, в принципе, и происходит в организме. Более того, в некоторых источниках говорится, что примерно половина поступающих с пищей бревен, рубится на дрова. А при сахарном диабете в условиях дефицита инсулина и того больше.
Но жалко, конечно, бревен. Увлекаться их топкой, означает ослабить саму конструкцию кочегарки. Поэтому глаз невольно переходит на уголь. Его тоже много. Тут даже можно как-то смириться с тем, что горит он плохо и чадит и коптит. Кстати, из него тоже можно получить немного сухих дровишек (глюконеогенез из жира), а остальное (жирные кислоты и кетоновые тела) просто жечь. Причем, рачительный хозяин должен будет беречь сухие дрова именно для тех печек, которые только ими топятся ( клетки центральной нервной системы и головного мозга, как ее составной части ). А остальные перебьются и углем.
Но вернемся к тем печкам, с которых начали.
Для того чтобы процесс подбрасывания в них дров протекал нормально, необходимо выполнить следующие условия :
1.Около печек необходимо иметь постоянный запас дров (необходимый уровень глюкозы в крови). 2.Необходимо иметь бригаду кочегаров (инсулин), которые «подбрасывают» дрова в печки. Просто подбрасывают. Гореть они будут потом и без участия этих кочегаров. 3.Необходимо иметь бригаду подсобных рабочих (глюкагон), которые подносят эти дрова по мере их расходования. Просто берут эти дрова из дровяного склада (гликогеновое депо) и кладут на транспортерную ленту (кровь). Она их донесет до печек в руки кочегаров. 4.Необходимо иметь бригаду подсобных рабочих (инсулин), которые занимаются «оприходыванием» (складированием) привозимых с пищей партий дров складывая их в поленницу или отвозя на склад, превращая их в уголь. Заодно, не забывая и о привозимых бревнах.
Давайте рассмотрим несколько режимов работы кочегарки. Начнем с самого простого: все тихо и спокойно. Новых партий дров никто не везет (человек не ест). Человек ведет размеренную и спокойную жизнь. Спит, к примеру. Тут все достаточно просто. Печки ( инсулиннезависимые и инсулинзависмые) горят в штатном режиме. Где-то горят сухие дровишки, где-то уголек. Работает автоматика, поддерживая постоянное количество дров на транспортерной ленте на уровне 3.3-5.5 ммоль/л. Эта же автоматика регулирует процессы рубки бревен (глюконеогенез из белка) и подготовки угля к топке (глюконеогенез из жира и кетогенез) так, чтобы количество дров на транспортерной ленте было нормальным. Нормальное количество дров на ленте является своего рода показателем того, что и все другие процессы проходят штатно. Штатно рубятся бревна, штатно готовится уголь к топке и т.д. Если количество дров стало уменьшаться ниже заданного уровня, то надо добавить глюкагона и уменьшить инсулина. Тем самым добавить дров из гликогенового депо или активизировать процесс глюконеогенеза. Если наоборот, количество дров на транспортерной ленте увеличилось, то наоборот надо увеличить инсулина и уменьшить глюкагона. Притормозить процесс отпуска дров со склада и уменьшить их образование из бревен и угля. Т.е. всего-то и надо: иметь датчик уровня глюкозы в крови, схему сравнения ее с эталоном, которая будет увеличивать бригаду инсулина или бригаду глюкагона.
Прошла ночь… Человек встал и сел завтракать. В нашем примере он стал завозить дрова в кочегарку. Что происходит? Да, в общем-то, ничего страшного. Мы же ведь поставили автоматику ! Количество привезенных дров больше, чем нужно сейчас для горения печек. Да мы их все туда запихивать не будем, иначе у нас «дым из ушей пойдет», образно говоря. Мы их будем складировать ! И тоже под управлением автоматики. С ее помощью мы даем команду: «Ты, глюкагон, сейчас не нужен. А ты, инсулин, надевай рукавицы и вперед. Более того, мы твою бригаду усилим дополнительными рабочими». В этом случае секреция глюкагона уменьшается, а секреция инсулина увеличивается. Что будет сигналом для САУ на подобные действия ? Все тот же растущий уровень глюкозы в крови. На этот раз, растущий по причине привоза дров. Что будет результатом такой работы ? Куда денутся привезенные дрова ? Во-первых, ими восполнится израсходованная за ночь поленница, а все, что сверху, будет трансформировано в «уголь» и отложится на угольном складе. Кстати, если размер поленницы ограничен этими 300-400 граммами гликогена, то размер угольного склада ограничен лишь размером брючного ремня, размерами воротника рубашки, размерами одежды и т.д. Т.е. способностью человека носить на себе эти запасы без ущерба для своего здоровья.
Аврал закончился. Пища переработалась и улеглась на соответствующих складах. В принципе, мы вернулись к тому режиму, что был ночью, но со своими нюансами. Суть этих нюансов заключается в том, что днем человек работает, учится, активно отдыхает и т.д. и т.п. Т.е. ведет весьма разнообразный, с точки зрения энергетики, образ жизни. Ну и что ? У нас же автоматика ! Она будет чутко реагировать за всеми этими изменениями, следя лишь за тем, чтобы уровень глюкозы крови был нормальным. Постоянство этого уровня и будет обеспечивать эти изменения в энергетических потребностях. Сидит человек у себя в офисе, размышляя между делом о таинствах диабета, это одно. Вышел он сразиться с соперниками по бизнесу на футбольном поле, это другое. Во втором случае надо будет добавить энергетических субстратов. И автоматика отработает это увеличение, следя за уровнем глюкозы крови.
Подводя итог сказанному, можно сделать вывод о том, что обмен веществ с точки зрения энергетики организма сводится к двум процессам :
1.Процесс накопления (депонирования) энергетических субстратов во время приема и переваривания пищи. К энергетическим субстратам, депонируемым в органах и тканях организма, относятся :
А) Гликоген, образующийся из глюкозы в результате «обработки» полученных с пищей углеводов. Депо для хранения гликогена являются клетки печеночной и мышечной ткани
Б) Аминокислоты, образующиеся в результате «обработки» полученных с пищей белков. Депо для хранения аминокислот являются клетки мышечной ткани.
В) Жиры, образующиеся в результате «обработки» полученных с пищей жиров и глюкозы, «не уместившейся» в гликогеновые депо. Депо для хранения жиров являются клетки жировой ткани.
2.Процесс получения энергетических субстратов из накопленных депо в промежутках между приемами пищи ( при голодании)
Получение и снабжение организма энергетическими субстратами происходит в результате следующих процессов:
А) процесса гликогенолиза, распада гликогена с получением свободной глюкозы Б) процесса глюконеогенеза, получения глюкозы из неуглеводных соединений. Процесс глюконеогенеза включает в себя :
-глюконеогенез из лактата, как продукта неполного окисления глюкозы в мышцах -глюконеогенез из аминокислот. Результатом этого процесса становится получение глюкозы и побочных продуктов, таких как аммиак -глюконеогенез из жиров. Исходным «сырьем» для этого процесса является глицерин, как составная часть депонированных в организме жиров. В процессе распада жира кроме глюконеогенеза из жира происходит освобождение жирных кислот, как другой составляющей депонированного жира. Часть жирных кислот окисляется с образованием кетоновых тел (кетогенез). Жирные кислоты и кетоновые тела также являются энергетическими субстратами.
Схема включения субстратов в глюконеогенез представлена на рисунке 2.8
Основными потребителями глюкозы, полученной в результате гликогенолиза и глюконеогенеза, являются клетки центральной нервной системы и головного мозга, как составляющей этой системы. Потребителями жирных кислот и кетоновых тел в качестве энергетических субстратов являются остальные органы и ткани.
Во всех этих процессах накопления и высвобождения энергетических субстратов участвует инсулин, как один из управляющих сигналов системы автоматического управления, следящей за уровнем глюкозы в крови. Дефицит инсулина (абсолютный или относительный) и причины возникновения этого дефицита приводят к отказу этой системы и появлению болезни под названием «сахарный диабет» того или иного типа и подтипа. Абсолютная (количественная) недостаточность инсулина приводит к сахарному диабету 1-го типа. В этом случае человек обязан перевести САУ в ручной режим управления, взяв на себя функции управления инсулярным плечом. При этом конечная эффективность этого управления будет зависеть от его точности и уровня приближения его к работе исправной САУ.
Хотя, если быть откровенным, то рядовому диабетику наверно и не обязательно знать все эти физиологические и биохимические тонкости. Так же, как рядовому водителю вовсе необязательно знать тонкости сложнейших термодинамических процессов, протекающих в цилиндрах двигателя его автомобиля. Но знать элементарное он обязан. Ну, хотя бы на каком топливе работает его автомобиль, чтобы не ошибиться при заправке и не загубить двигатель.
Из всего сказанного выше можно сделать три вывода:
Тем, кого не очень интересуют все эти «глюкозо 6 фосфаты» или тем, кто с трудом произносят сии мудреные слова ( как автор этого «труда», к примеру), достаточно пропустить эту главу, ограничившись запоминанием этих трех выводов, как аксиомы. Только этого будет вполне достаточно для понимания того, о чем пойдет речь дальше, т.е. о точной инсулинотерапии.
У дотошного читателя может возникнуть естественные вопросы типа:
- Зачем тебе, дилетанту, нужны все эти «глюкопонтазы»? Неужели в твоей жизни нет ничего более интересного? Будь проще: укололся, гипонул, сахарком закусил и опять человек. Недокололся? Тоже нет проблем. Шарахнул дозу и все дела. Опять гипонул? Тогда смотри выше…
- Ну а раз ты завел о них разговор, то объясни мне, зачем они нужны МНЕ? Пусть мой лечащий врач в них разбирается. На то он и врач. Он мне должен говорить, что и сколько я должен колоть. За это ему зарплату платят.
- Диабетических осложнений испугался? Не бойся. Это неизбежно, как бы ты не старался. Судьба у нас такая, диабетическая…
Отвечаю:
Все это я рассказывал лишь для того, чтобы убедить Вас, читатель, лишь в следующем:
Неубедительно? А я никого убеждать и не собирался.
Тем, для кого это не дошло, дальше можно не читать. Вперед к участковому эндокринологу!
Тем, для кого это дошло, предлагаю продолжение «беседы» с переносом ее в практическую плоскость, т.е. с переходом к следующей главе.